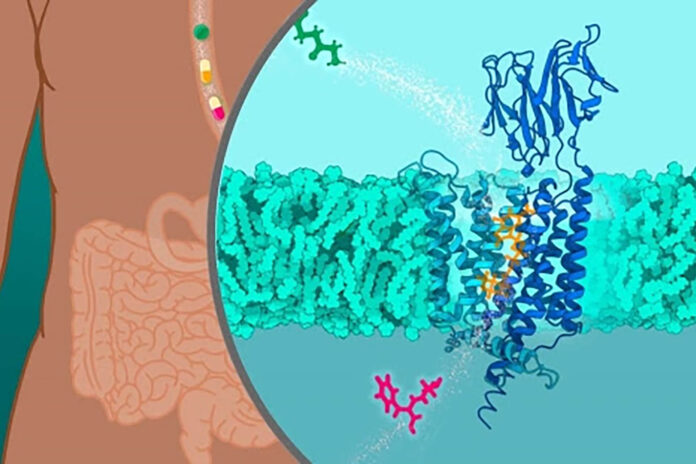
Wetenschappers van EMBL Hamburg en CSSB hebben de moleculaire structuur bepaald van een darmeiwit dat ons helpt veel medicijnen te absorberen. Dit zou kunnen helpen om medicijnen te ontwikkelen die doelweefsels efficiënter bereiken.
Hoe het menselijk lichaam voedingsstoffen opneemt, is niet alleen de sleutel tot voeding, maar ook voor de effectiviteit van medicijnen. Onderzoekers van het European Molecular Biology Laboratory (EMBL) in Hamburg en het Center for Structural Systems Biology (CSSB) hebben de moleculaire structuur bepaald van peptidetransporter 1 (PepT1), een klein eiwit dat verteerde eiwitten van de darm naar de bloedbaan transporteert. Ze bereikten dit met behulp van cryo-elektronenmicroscopie, een techniek waarbij bevroren monsters worden afgebeeld met elektronen in plaats van licht. PepT1 vervoert ook veel medicijnen, waaronder antibiotica en antivirale middelen. Het proces van orale en intestinale absorptie van geneesmiddelen is vaak inefficiënt, omdat slechts een klein deel van het geneesmiddel in de bloedbaan terechtkomt. Door de moleculaire structuur van PepT1 te kennen, kunnen wetenschappers medicijnen ontwerpen of aanpassen zodat ze efficiënter kunnen worden opgenomen.
De menselijke peptidetransporter PepT1 transporteert verteerde eiwitten vanuit de darm naar de bloedbaan. PepT1 vervoert ook veel medicijnen, waaronder antibiotica en antivirale middelen. De structuur van PepT1 in de afbeelding is gebaseerd op de PDB-vermeldingen: 7PMW, 7PMX, 7PMY en 7PN1. Credits: Isabel Romero Calvo/EMBL
Het promiscue eiwit dat ons gevoed houdt
Tijdens de spijsvertering worden de eiwitten die we eten afgebroken tot kleinere stukjes, peptiden genaamd, die bestaan uit aminozuren die ons lichaam later gebruikt om zijn eigen eiwitten te bouwen. Voordat dat gebeurt, moeten peptiden eerst van de darm naar de bloedbaan worden getransporteerd. Deze taak wordt uitgevoerd door een molecuul genaamd peptidetransporter 1 (PepT1), dat in het celmembraan van de darmwand zit en kleine peptiden door het celmembraan beweegt.
In het menselijk lichaam zijn er ongeveer 800 transportsystemen gewijd aan verschillende soorten voedingsstoffen. De meeste zijn zeer gespecialiseerd. Bepaalde suikertransporteurs kunnen bijvoorbeeld maar één soort suiker opnemen. PepT1 is echter anders: het kan bijna elk type kort peptide transporteren. In wetenschappelijk jargon wordt dit vermogen ‘promiscuïteit’ genoemd.
Groepsleider Christian Löw is de expert van EMBL Hamburg op het gebied van membraaneiwitten. Zijn groep bepaalde samen met collega’s van het Center for Structural Systems Biology (CSSB) en de Universitätsklinikum Hamburg-Eppendorf (UKE) de moleculaire structuren van menselijk PepT1 en zijn relatieve PepT2, dat voornamelijk in de nier aanwezig is voor de opname van voedingsstoffen. De wetenschappers gebruikten cryo-elektronenmicroscopie, een techniek waarbij bevroren monsters worden afgebeeld met elektronen in plaats van licht.
Nieuwe mogelijkheden om het medicijnontwerp te verbeteren
De promiscuïteit van PepT1 stelt het in staat om niet alleen voedzame peptiden te transporteren, maar ook verschillende soorten medicijnen, waaronder bepaalde antibiotica, antivirale middelen en medicijnen voor hypertensie. PepT1 transporteert medicijnen echter minder efficiënt dan veel van de natuurlijke peptiden. Als gevolg hiervan komt slechts een fractie van de medicijnen die we binnenkrijgen in onze bloedbaan terecht. De rest blijft in de darm, wat kan leiden tot verschillende bijwerkingen. Het verhogen van de dosering van medicijnen om inefficiënt transport te compenseren is bijzonder gevaarlijk in het geval van antibiotica, omdat dit kan leiden tot het ontstaan van antibiotica-resistente bacteriën.
“Nu we weten hoe de PepT1-structuur eruit ziet, zal het mogelijk zijn om nieuwe medicijnen te ontwerpen die PepT1 gebruiken om de darmwand veel efficiënter dan voorheen te passeren”, zei Löw. “De structuur van humaan PepT1 stelt ons in staat om het medicijnontwerp te verbeteren door de absorptie efficiënter te maken. Momenteel is het bijna onmogelijk om te voorspellen of een kandidaat-geneesmiddel via dit transportsysteem de darmwand kan passeren. Tot nu toe was het verkrijgen van zo’n medicijn een hele uitdaging. Veel potentieel effectieve kandidaat-geneesmiddelen hebben gefaald in preklinische onderzoeken omdat ze slecht werden geabsorbeerd. Met behulp van de structurele informatie voor PepT1 konden sommige van die mislukte kandidaten opnieuw worden ontworpen, zodat ze efficiënt door PepT1 konden worden vervoerd. Evenzo zouden veel bestaande medicijnen kunnen worden aangepast om hun absorptie te verbeteren.”
Kijken naar de transporter in stop-motion
De moleculaire structuur van humaan PepT1 is een van de kleinste structuren die met cryo-elektronenmicroscopie zijn bepaald. Het lijkt op een klem die open is naar de binnenkant van de darm. Wanneer een peptide aan PepT1 bindt, sluit de klem zich eromheen en gaat dan open naar de andere kant van het membraan om het los te laten. De wetenschappers bepaalden niet alleen de structuur van de transporter, maar legden deze zelfs vast in verschillende toestanden tijdens de transportcyclus.
“We hebben het hele transportproces in moleculair detail gevisualiseerd, zoals in een film”, zegt Maxime Killer, eerste auteur van het onderzoek. “Membraaneiwitten zijn notoir moeilijk te bestuderen, maar we hopen dat de trucs die we hebben ontwikkeld om PepT1 te bestuderen, andere wetenschappers zullen helpen om de structuren van vergelijkbare eiwitten in de toekomst op te lossen.”